Lipidi. Oli e grassi. Mono-, Di- e Trigliceridi. Acidi grassi saturi ed insaturi. Acido stearico, oleico, linoleico e linolenico.










Benzene e strutture di risonanza. Idrogenazione del cicloesene, del 1,3-cicloesadiene e dell’ipotetico 1,3,5-cicloesatriene.
Aromaticità come extra-stabilizzazione. Nomenclatura dei derivati aromatici disostituiti. Orto, meta e para-dimetilbenzeni o xileni.
Fenoli. Stabilità dei fenoli in comparazione agli enoli. Acidità dei fenoli. Comparazione acidità fenolo-cicloesanolo. Stabilizzazione per risonanza dello ione fenato. Fenoli sostituiti. Maggiore acidità del p-nitrofenolo rispetto al fenolo. Strutture di risonanza. Acido picrico (2,4,6-trinitrofenolo).
Esercitazione del 5 dicembre 2007
Stereochimica assoluta e relativa. Acido D-lattico come sinonimo dell'acido (2R)-idrossipropanoico.
Acido D-tartarico, L-tartarico e meso-tartarico come sinonimi degli acidi (2S,3S), (2R,3R) e (2S,3R)-diidrossisuccinici. Attribuzione della configurazione assoluta in una proiezione di Fisher.
Composti aromatici. Benzaldeide; Vanillina; THC; Mescalina [2-(3,4,5-trimetossifenil)-amminoetano]; Anisolo; 2,6-dicloro-anisolo.
Ammine aromatiche. 4-Cloro-5-metil-2-nitroanilina. Differenza di basicità tra ammine aromatiche e ammine alifatiche.
Anilina e cicloesilammina.
Regole generali per definire l’aromaticità di una specie molecolare. Strutture cicliche, ibridazione sp2 dei carboni e regola di Huckel (4n+2) degli elettroni pi greca.
1,3-Ciclobutadiene e Naftalene. 1,3,5-Cicloeptatriene. Il caso del catione ciclopropenilico. Ione tropilio. Differenza di acidità tra l’1,3-ciclopentadiene e ciclopentene.




Lezione ed Esercitazione
Gruppi funzionali. Installazione e utilizzo di software in chimica organica. Funzioni principali. Molecole in 3d. Alcoli a 4 atomi di carbonio di formula molecolare C4H10O. Isomeria strutturale. Relazione tra struttura e proprietà. Proprietà odorose degli alcoli di formula C4H10O. Soluzioni etanoliche al 10% di 1-butanolo, 2-butanolo, 2-metil-1-propanolo, 2-metil-2-propanolo.
Aldeidi e chetoni. Nomenclatura.
Derivati degli acidi carbossilici: gli esteri. Componente acida e componente alcolica. Nomenclatura. Acetato di butile. Butirrato di butile.

Derivati degli acidi carbossilici: le ammidi. Differenza tra ammine ed ammidi. La risonanza. Molecole organiche contenenti il gruppo amminico come sostituente. Gli amminoacidi. I peptidi. Il legame ammidico. Assenza di rotazione attorno al legame ammidico.
Alogenuri alchilici.

Introduzione alla stereoisomeria. Alcheni. 1-butene, 2-butene. Isomeria geometrica. I simboli E e Z. Regole di Priorità. Applicazioni.
Polieni. Beta-carotene



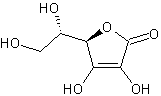
3. Scrivere ed elencare secondo acidità crescente le molecole di seguito elencate: a) 2-nitrofenolo; b) fenolo; c) 2-metil-ciclopropanolo; d) acido 3-fluorobutanoico; e) acido 2-cloropropanoico; f) metil-ciclobutano;
4. Dare una spiegazione del fatto che il cicloesene reagisce rapidamente con il bromo, mentre il benzene è inerte.
5. Scrivere la struttura di a) un D-amminoacido; b) un L-chetoesoso; c) un Trigliceride; d) un nucleoside; e) un estere.
8. Indicare quali tra le specie chimiche proposte di seguito può definirsi aromatica.
9. Illustrare un metodo per separare la 3,5-dietilanilina dal 1,3-dietilbenzene.
10. Scrivere le strutture delle seguenti sostanze: a) un dipeptide formato solo da D-amminoacidi; b) Gli anomeri di un D-aldotreoso chiuso in forma furanosica;c) Il digliceride formato dall’acido butirrico.
CdL Viticoltura ed Enologia
ESAME SCRITTO DI CHIMICA ORGANICA 19 febbraio 2007
11. Dare un nome alle molecole di seguito indicate, specificando per ognuna il numero degli stereoisomeri possibili.
12. Indicare quali caratteristiche deve possedere una molecola organica per definirsi aromatica.
13. Illustrare un metodo per separare l’acido 3-metilbenzoico dal clorobenzene.
14. Scrivere le strutture generiche delle seguenti sostanze: a) un D-aldochetoso; b) un b-ammino acido; c) il trigliceride formato dall’acido butirrico; d) un emiacetale ciclico; e) un nucleoside presente nel DNA; f) un acido grasso monoinsaturo.
15. Scrivere ed elencare secondo basicità crescente le strutture delle molecole di seguito mostrate. a) Etilammina; b) Diisopropilammina; c) Ammoniaca; d) Anilina; e) 4-nitroanilina; f) 1,3,5-trimetilbenzene.